Растворимость — стекло
Cтраница 1
Растворимость стекла в воде зависит от модуля стекла. С понижением модуля повышается растворимость стекла в воде, с повышением модуля — снижается. [1]
Растворимость стекла в воде зависит от его модуля. С понижением модуля повышается растворимость в воде, с повышением модуля — снижается. [2]
Растворимость стекла по сравнению с интересующими нас концентрациями относительно велика. В воде или водных растворах оказывается не только щелочь ( NaOH, КОН), вымываемая из стекла. Растворимость стекла оказывается, следовательно, причиной увеличения концентрации очень разбавленных растворов солей натрия, калия, кальция, железа и др. и причиной загрязнения других растворов. [3]
Поэтому для уменьшения загрязнения вследствие растворимости стекла рекомендуется обработка стеклянных сосудов водяным паром. [5]
Очень резко проявляется введение 15 молей глинозема: поверхность растворимости стекол без глинозема-сечение MNKL ( фиг. Таким же образом Кеппелер и Кернер25 на-гили, что 3 % трехокиси бора, замещающей щелочи, наиболее эффектно улучшают химическую стойкость. [6]
На рис. 256, на графике б, показано, как изменяется растворимость стекол в кипящем растворе, соды ( 250 мл) при изменении их химического состава. Числа у кривых равной растворимости показывают потерю в весе в миллиграммах 10 г порошка стекла после кипячения его в растворе соды. [8]
Стойкость к действию влаги оценивается массой составных частей стекла, переходящей в раствор с единицы поверхности стекла при длительном соприкосновении его с водой; растворимость стекла увеличивается при возрастании температуры. Стекла с низкой гидролитической стойкостью обладают малым поверхностным удельным сопротивлением в условиях влажной среды. Наивысшей гидролитической стойкостью обладает кварцевое стекло; гидролитическая стойкость сильно уменьшается при введении в стекло щелочных оксидов. [9]
Стойкость к действию влаги оценивается по количеству составных частей стекла, переходящих в раствор с единицы поверхности стекла при длительном соприкосновении его с водой; растворимость стекла увеличивается при возрастании температуры. [10]
Гидролитическая стойкость, то-есть стойкость к действию влаги, оценивается по количеству составных частей стекла, переходящих в раствор с единицы поверхности стекла при длительном соприкосновении его с водой; растворимость стекла увеличивается при возрастании температуры. [11]
При приготовлении реактивов следует принимать специальные меры предосторожности в связи с возможностью попадания в реактивы небольших количеств натрия, которые могут находиться на коже пальцев, а также из-за возможности химических загрязнений, например вследствие растворимости стекла. Для приготовления растворов следует пользоваться дважды перегнанной водой; вторая перегонка дестиллированной воды проводится в стеклянном приборе со шлифами. [12]
Титрованные растворы для ультрамикрообъемного анализа готовят в меньших количествах, чем для макроанализа, но не в слишком малых ( 5 — 10 мл), так как изменения титра раствора в связи с их испарением или растворимостью стекла велики в случае малых объемов. Следует в то же время иметь в виду, что для получения правильных результатов необходимо пользоваться при вычислениях нормальностью рабочего раствора, которая определена титрованием соответствующего стандартного раствора. [13]
Титрованные растворы для ультрамикроанализа готовят в меньших количествах, ччем для микроанализа, но не в слишком малых ( 5 — 10 мл), так как в случае малых объемов изменение титра раствора в связи с их испарением или растворимостью стекла велико. Следует, однако, иметь в виду, что для получения правильных результатов п
Растворимое стекло
Растворимое стекло — затвердевший стекловидный сплав (силикат натрия и/или силикат калия), или же раствор этих силикатов калия (K2SiO3) и/или натрия (Na2SiO3) с гидратированным оксидом кремния (SiO2·xH2O). В жидком виде используется в строительстве и быту в качестве клея, называется силикатным клеем.
Синонимы: Фуксово стекло (силикат; Wasserglas, verre soluble, waterglass, soluble glass).
Текст из словаря Брокгауз и Ефрон
Растворимое стекло состоит из растворимых в воде кремнекислых солей щелочных металлов, именно калия или натрия или обоих вместе. Растворимое кремнекислое соединение калия было известно еще алхимикам в XVI столетии, но их работы были забыты, так что получение растворимого стекла приписывается обыкновенно Фуксу (J. Н. Fuchs), описавшему его приготовление в 1818 г. и впервые указавшему его практические применения. Растворимое стекло по внешнему виду очень сходно с настоящим стеклом, представляя прозрачную стекловидную массу, бесцветную, зеленоватую или буровато-желтую, имеющую раковистый излом с острыми краями.
Растворимое стекло бывает троякого рода; калиевое, натриевое и двойное (Doppelwasserglas), содержащее кремнекислый калий и кремнекислый натрий вместе. По техническим свойствам все эти роды растворимого стекла одинаковы, а потому обыкновенно приготовляют и употребляют натриевое стекло, но в некоторых случаях, напр. для прибавления к мягким мылам, применяется калиевое стекло. Количественный состав разных сортов Р. стекла не одинаков, напр. состав продажного натриевого стекла изменяется в пределах от 2Na2O · 5SiO2 до Na2O · 4SiO2.
Растворимое стекло употребляется в практике и поступает в продажу в виде более или менее концентрированных водных растворов желтоватого или буровато-желтого цвета, содержащих до 66 проц. силиката; обыкновенно же они содержат только 33 проц. стекла, имея плотность в 33° В.
Приготовление
Растворимое стекло приготовляют: 1) посредством сплавления и 2) мокрым путем.
- По первому способу для получения калиевого стекла сплавляют 45 кг измельченного кварца, 30 кг поташа и 3 кг древесноугольного порошка (по Фуксу) или 180 ч. белого песка, 125 ч. поташа (содержащего 90 проц. K2CO3) и 3 ч. древесноугольного порошка (по Шюру). Полученную после сплавления стекловидную массу, окрашенную от угля в темный цвет, размельчают и оставляют некоторое время на воздухе. Масса притягивает влагу, посторонние соли выветриваются и могут быть удалены посредством промывания холодной водой, в которой само стекло растворяется весьма медленно. Затем нагревают с водой при кипячении, при чем стекло вполне в ней растворяется и образует при известной концентрации сиропообразный раствор, тянущийся в нити. Для натриевого стекла материалы сплавляют в следующих пропорциях: 45 кг кварца, 23 кг прокаленной соды и 3 к. древесноугольного порошка или 100 кг кварца, 60 кг сульфата и 20 к. древесного угля (по Бухнеру) или 180 ч. белого песка, 100 ч. прокаленной соды (в 90 проц.) и 3 ч. древесного угля. Сплавленную массу растворяют в воде, нагревая ее с последней, лучше всего в закрытых котлах паром. Сплавление массы для Р. стекла производят или в газовых стекловаренных печах, в горшках или в ваннах, или прямо на поде пламенных печей. Из стекловаренных газовых печей применяются преимущественно печи с так называемыми рекуператорами, т. е. печи, в которых подогревается только поступающий в них воздух, между тем как сжигаемый в них генераторный газ не подвергается подогреванию; в этих печах направление пламени не изменяется периодически, как напр. в печах с регенераторами Сименса, а остается постоянным. Из газовых печей, применяемых для приготовления растворимого стекла, можно указать на печь системы Неезе (Nehse) и на печь Пютча (А. Putch). Из обыкновенных пламенных печей применяется непрерывно действующая печь Капитена (Capitaine), дающая до 1250 к. в сутки при расходе до 1500 к. угля. Плавка массы в этой печи происходит на ее поде; готовое стекло стекает через отверстие в поде в железные ящики.
Мокрый способ
- Мокрый способ приготовления растворимого стекла состоит в нагревании растворимых в щелочах видоизменений кремнезема с едкими щелоками; именно для этого употребляют кремень и инфузорную землю. При приготовлении Р. стекла из инфузорной земли [Если инфузорная земля сильно окрашена от присутствия органических веществ, то ее предварительно прокаливают.] ее нагревают с едким щелоком или под обыкновенным, или под повышенным давлением. Напр., при приготовлении натриевого стекла нагревают при кипячении инфузорную землю с раствором едкого натра уд. веса 1,15, по растворении прибавляют немного известковой воды для очищения от органических веществ, при чем образуется бурый осадок. Из 120 част. инфузорной земли получается до 240-250 част. студенистой массы, содержащей 47 проц. безводного натриевого стекла. Из 120 ч. инфузорной земли, обработанной 263 ч. калийного щелока уд. веса 1,135, получают 230 ч. студенистой массы с 59 проц. сухого калиевого стекла. По Капитену, инфузорную землю нагревают с натровым щелоком уд. веса 1,22-1,25 в закрытом котле с мешалкой; нагревание производят паром под давлением 3 атмосфер в течение 3 часов; относительные количества употребляемых материалов должны быть таковы, чтобы на 1 ч. едкого натра приходилось 2,8 ч. кремнезема. Признаком конца реакции служит темно-красный цвет раствора от взвешенных в нем нерастворимых веществ и быстрое осветление при отстаивании; если был употреблен избыток кремнезема или нагревание было недостаточно продолжительно, а также при пользовании более крепкими натровыми щелоками, то жидкость не осветляется при отстаивании. Плотность получаемого раствора стекла обыкновенно 1,16-1,18; если уд. вес выше, то раствор разбавляют до этой концентрации водой; при таких условиях жидкость обыкновенно осветляется через сутки.
Применение
(данные устарели, приведено по ЭСБЭ) Для медицинских целей употребляют калиевое стекло, по возможности насыщенное кремнеземом, и для его приготовления берут на 10-15 проц. кремнезема больше против обыкновенного, а также нагревают 1-2 часа более. При этом получают раствор уд. веса 1,32, застывающий в студенистую массу. При приготовлении Р. стекла из кремня не достигают насыщения кремнезема щелочью в такой степени, как при употреблении для этого инфузорной земли. Поэтому весьма часто поступают так, что сначала нагревают размельченный кремень с натуральным щелоком в закрытом котле до возможно полного насыщения, а затем, для окончательного насыщения кремнеземом, раствор переводят в другой котел, в котором нагревают с инфузорной землей.
Р. стекло употребляется ныне в больших количествах в мыловаренном производстве, при приготовлении так наз. наполненных мыл.
В строительном деле Р. стекло применяется для напитывания камней из рыхлых горных пород и для смазывания оштукатуренных стен; это применение основано на действии щелочных силикатов на кальциевые соли, из которых, напр., аморфная углекислая соль (мел) делается от действия силиката твердой, как мрамор, и непроницаемой для влаги.
Растворимое стекло употребляется также при приготовлении искусственных камней, для покрывания дерева с целью сделать его несгораемым, для сгущения таких красок, которые не изменяются от щелочей, а также для особого рода живописи (стереохромия).
Внешние ссылки
История силиката натрия
См. также
Является ли стекло растворимым в воде?
Нет. Это твердое тело. Даже расплавленное стекло не растворяется в воде.
Почему соль не растворяется в масле, а растворяется в воде?
вода — это полярная молекула. Создайте электрический диполь между водородным (положительным) и кислородным (отрицательным) водным диссоциатом по ионной связи соли, образующей положительные и отрицательные ионы. Это приводит к сильному взаимодействию между водой и солью
Растворимость воды?
Вода считается растворителем, а не растворителем, поэтому ее собственная растворимость не является проблемой.
Почему растворимость не растворяется в воде?
из-за наличия неполярной группы, которая является бензольным кольцом, растворимость в воде уменьшается, хотя она имеет водородную связь.
Является ли водорастворимый?
Предполагаю, вы имеете в виду: «Вода растворима в воде?». Ответ — нет. Это может показаться странным, но это не так. Химические вещества, растворимые в воде, имеют символ состояния (aq), но вода имеет символ состояния (1).
Почему я не растворяюсь в воде?
I или йод слабо растворим в воде. Посмотрите ссылку на информационный лист продукта ниже
Является ли четыреххлористый углерод растворимым в воде?
Нет, потому что межмолекулярные силы между углеродом и хлором сильны и не растворимы в воде.
Является ли натрий растворимым в воде?
Нет, натрий будет сильно взрываться, если его коснется вода. Соль, которая является хлоридом натрия, растворима.
Является ли оксид магния растворимым в воде?
Нет, оксид магния практически нерастворим в воде; растворимость при комнатной температуре составляет 0,086 г / л.
Что такое наиболее растворимое соединение в воде?
Метанол, этанол и пропанол, все растворяют% 100 в воде. Металлические ионные соединения Alsogroup 1 очень хорошо растворяются в воде.
Что такое растворимость воды?
Вода — изогнутое, полярное соединение и обладает способностью к водородной связи. В результате он обладает уникальными характеристиками растворимости в качестве растворителя и функционирует по-разному при разных температурах.
Какие вещества растворимы в водном песке сахарного масла?
Ну, песок падает на дно, настолько нерастворимый. Сахар растворяется в воде — теплая вода растворяет его быстрее (кофе, чай), масло сидит в слое сверху, поэтому не растворяется. Стекло, которое, к счастью, стекло нерастворимо в воде, поэтому кокс и тому подобное могут содержаться в стеклянных бутылках. Пурист, который измеряет растворимость в атомах или молекулах на литр, будет утверждать, что все нерастворимые вещества растворяются в некоторой степени.
Что такое липид-растворимые и водорастворимые витамины?
Липид-растворимые витамины такие, как A, D, E и K. Водорастворимые витамины не могут храниться организмом в значительных суммы в течение продолжительных периодов времени.
Жир кальция растворимый или водорастворимый?
Кальций является водорастворимым, но не является жирорастворимым. Это пятый наиболее растворенный ион в морской воде. С другой стороны, жир растворяется в кальции в организме. Кальций будет выделять жир из пищи в пищеварительной системе, и они объединяются, образуя пенистое вещество, которое не поглощается телом, и поэтому жир будет вымываться.
Как вы отделяете химическое вещество, растворимое в воде, из растворимого в воде?
Легко отделить химическое вещество, которое не растворяется в воде из химического вещества, которое растворимый в воде. Вы добавляете воду. Объяснение: растворимый химикат будет смешиваться с водой, оставляя слой нерастворимого химиката сверху или снизу, в зависимости от плотности. Затем вы можете извлечь верхний слой с помощью пипетки или запустить его, если вы используете бюретку.
Что делает растворимый в растворе растворимый в воде?
Чтобы понять, почему вещи вообще растворяются, мы рассмотрим процесс формирования раствора с термодинамической точки зрения. показывает термодинамический цикл, который представляет собой образование раствора из изолированного растворенного вещества и растворителя. Из закона Гесса мы знаем, что мы можем добавить энергии каждого шага в цикле для определения энергии всего процесса. Таким образом, энергия образования раствора, энтальпия раствора, равна сумме трех этапов — Î? H soln = Î H 1 + Î H 2 + Î H 3 истина, что я не имею ключ………………….
Стекла растворимость — Справочник химика 21
Мазут 910-990 Стекло растворимое [c.108]СТЕКЛО РАСТВОРИМОЕ — смесь силикатов натрия и калия (или только натрия), водные растворы которых называются жидким стеклом. С. р. применяют для изготовления кислотоупорных цементов и бетонов, для пропитки тканей, изготовления огнезащитных красок, силикагеля, для укрепления слабых грунтов, канцелярского клея и др. [c.237]
Измерительную посуду очищают пропариванием. При этом одновременно происходит выщелачивание из стекла растворимых составных частей. Пропаривание производят, пользуясь специальным прибором (рис. 10), пока на стенках очищаемого сосуда не будут заметны капли. [c.297]
Среди сравнительно небольшой группы водорастворимых силикатов наиболее широко а промышленности, в частности, в практике противокоррозионной зашиты, используют силикат натрия (технические названия — жидкое стекло, растворимое стекло, силикатный клей). [c.25]
Силикат натрия растворимый (силикат глыба, стекло растворимое) [c.210]
Силикат натрия, кремнекислый натрий, стекло растворимое — куски, похожие на стекло, получают сплавлением при 1300—1500° С кремнезема с содой или сернокислым натрием (в последнем случае с добавлением угля). Применяется для приготовления жидкого стекла автоклавным или безавтоклавным растворением. [c.702]
Стекло Жидкое стекло, растворимое стекло, стеклянная вата, растворимое стекло с пемзой (паста) [c.530]
Опыты магнитной обработки растворов реагентов-регуляторов проводили в основном с жидким стеклом (растворимый силикат натрия), являющимся почти универсальным подавителем флотации и регулятором свойств пены. Известно, что флотационные свойства жидкого стекла зависят от степени его полимеризации [143]. Выше (п. 2, гл. П) было рассмотрено влияние магнитной обработки на растворы жидкого стекла. [c.167]
Иногда для очистки посуды прибегают к пропариванию. Для этого очищаемый сосуд надевают на трубку показанного на рис. 11 прибора, через которую в него поступает струя пара из колбы с кипящей водой. Конденсирующаяся на стенках сосуда вода стекает 4ерез воронку обратно в колбу. Пропаривание продолжают до тех пор, пока на стенках очищаемого сосуда уже не будет заметно капель. При этой операции достигается не только тщательная очистка сосуда, но и выщелачивание из стекла растворимые составных частей его, что иногда необхо-дивю. [c.47]
Смесь цинкового порошка с жидким стеклом в соотношении 80 20 уже является цинкпротекторным лакокрасочным материалом, но севастопольские ученые для придания покрытиям из этой краски более высокой водостойкости предложили вводить в исходные композиции отвердитель жидкого стекла — растворимые кальциевые соли фосфорной кислоты.. [c.73]
Кислотоупорные В. м. состоят в осн. из кислотоупорного цемента, содержащего тонкоизмельченную смесь кварцевого песка и Na2SiFj их затворяют, как правило, водными р-рами силиката Na или К (см. Стекло растворимое), они длительно сохраняют свою прочность при воздействии к-т. При твердении осуществляется р-ция [c.448]
В качестве кислотоупорного сырья можно использовать также кислотоупорный цемент вяжущее силикатное в-во на основе прир. цементного сырья с добавками стекла растворимого и Na2SiF6 (в СССР 317 месторождений прир. цемента), металлургич. шлаки (шлакосиликаты), топливные ->олы Т Ц и др. отходы пром. предприятий. [c.392]
МПа, а также р-римого стекла в виде сшшкат-глыбы или силикат-гранулята (см. Стекло растворимое) в горячей воде при давлении водяного пара 0,3-0,8 МПа. Нераство рившиеся примеси отделяют декантацией или фильтрацией Для облегчения фильтрации С. ж. разбавляют до плотн. ок 1,25 г/см , а после фильтрации упаривают до плотн [c.421]
Из однокомпонентных С.н. наиб, значение имеет силикатное стекло кварцевое, из бинарных-щелочносиликатные С. н. состава М20 -8Ю2 (М = На, К), т. наз. стекло растворимое, из многокомпонентных-щелочносиликатные С.н., содержащие оксиды Са, Mg, А1. Хим. состав нек-рых видов оксидных промьшшенрых С.н. приведен в таблице. [c.422]
СТЕКЛО РАСТВОРИМОЕ (силикат-глыба, силикат-грану-лят), стеклообразный силикат щелочных металлов общей ф-лы Я20-т8102, где К = Ка, К, 1л, т-т. наз. кремнеземистый модуль. Различают С.р. натриевое, калиевое, сме- [c.425]
Стекло растворимое — стекловидная масса, смесь силикатов натрия и калия. Получают сплавлением 510г с карбонатами калия и натрия. Растворимое стекло в виде водных растворов, называемых жидким стеклом, применяют для изготовления кислотоупорного цемента и бетона, для пропитывания тканей, пригоговле-ния огнезащитных красок по дереву, укрепления слабых грунтов и др. [c.127]
В стекловарении используют только самые чистые разновидности кварцевого песка, в которых общее количество загрязнений не превышает 2—3 %. Особенно нежелательно присутствие железа, которое даже в ничтожных количествах (десятые доли %) окрашивает стекло в зеленоватый цвет. Если к песку добавить соду ЫагСОз, то удается сварить стекло при более низкой температуре (на 200—300°). Такой расплав будет иметь менее вязкий (пузырьки легче удаляются при варке, а изделия легче формуются). Но Такое стекло растворимо в воде, а изделия из него подвергаются разрушению под влиянием атмосферных воздействий. Для придания стеклу нерастворимости в воде в него вводят третий компонент — известь, известняк, мел. Все они характеризуются одной и той же химической формулой — СаСОз. [c.45]
Обычное порошкообразное стекло, затворенное щелочным силикатом, быстро превращается в камневидное тело, водоустойчивость которого возрастает с ростом модульности жидкого стекла. Растворимое стекло применяют также для стекловарочных печей в качестве уплотнительной обмазки. Затворителем такой обмазки служит высокомодульное стекло (М 3, р = 1,4 г/см ). Порошковая часть состоит из следующих компонентов, % (по массе) молотый асбест — 20 песок — 40 маршаллит — 20 каменноугольный песок— 15 кремнефторид натрия — 5. [c.142]
Растворимые стекла (растворимые силикаты натрия и калия) представляют собой вещества в стеклообразном состоянии, характеризующиеся определенным содержанием и соотношением оксидов — М2О и S1O2, где М — это Na и К, а мольное соотношение Si02/M20 составляет 2,6—3,5 при содержании Si02 69— 76 масс. % для натриевого стекла и 65—69 масс. % — для калиевого.
Стекло действие воды — Справочник химика 21
Даже очень тонкого слоя такой смеси вполне достаточно для защиты поверхности стекла от действия плавиковой кислоты. Посредством иглы на защитном слое стекла наносят нужную надпись, а затем эти места с помощью кисточки смачивают плавиковой кислотой. Через несколько минут травление заканчивается, стекло промывают водой и при помощи нагревания освобождают от защитного слоя. [c.304]Препаративный метод исследования имеет огромное значение, однако применение его при исследовании многих объектов, представляющих большой интерес для науки и промышленности (растворы, сплавы, стекла, шлаки и другие вещества, названные Д. И. Менделеевым соединениями неопределенного состава), встречает огромные, часто непреодолимые экспериментальные трудности и не позволяет получить положительные результаты. Рассмотрим два примера. Такая, на первый взгляд простая операция, как отделение при обыкновенной температуре от маточного раствора соли, выкристаллизовавшейся из жидкой среды, становится крайне затруднительной, если маточный раствор обладает большой вязкостью, а соль разлагается под действием воды или другого растворителя, применяемого для отмывания маточного раствора. Еще более трудно и часто невозможно отделить твердое вещество от жидкого при высоких температурах, например в металлических, соляных, сульфидных и силикатных сплавах. [c.166]
Обыкновенное мягкое натриевое или калиевое стекло неустойчиво к резким изменениям температуры и обладает довольно большой растворимостью Б растворах оснований и кислот оно находит применение для изготовления бутылок, банок, склянок, колб Бунзена, склянок Вульфа и т, д. Специальное мягкое стекло, применяемое ддя изготовления лабораторной посуды и приборов (иена 16 III) отличается довольно большой устойчивостью к действию воды и едких веществ, но недостаточно устойчиво к резким изменениям температуры. В лабораториях чаще всего применяется иенское стекло иена 20 , так как, кроме ценных механических свойств, оно обладает относительно малым коэффициентом линейного расширения (4,8-10 ) и относительно большой устойчивостью к действию воды, кислот, оснований и солей температура размягчения его равна 570°. [c.74]
Стекло — химически довольно стойкий материал. Кислоты, за исключением плавиковой н фосфорной, практически не действуют на стекло. Однако нет таких стекол, которые бы совсем не реаги ровали с водой и щелочами. При длительном воздействии щелочей на стекло происходит его выщелачивание, изменение состава, вида и свойств. При действии воды происходит гидролиз стекла, в результате которого некоторое количество щелочи и други.ч растворимых компонентов переходит в воду их можно определить титрованием 0,01 н. НС1 Чем больше кислоты пошло на титрование, тем менее стойким к воздействию воды было стекло. [c.19]
По отношению к действию воды стекла делят на пять гидролитических классов. [c.19] Безопасные стекла. Вероятно, каждому городскому жителю довелось видеть на автотранспорте разбитое лобовое стекло. Первым из безопасных стекол, примененных для остекления автомобилей, был триплекс. Он и в настояш,ее время несет свою службу. При ударе на триплексе образуются многочисленные радиальные и концентрические трещины, но не осколки. Это резко снижает возможность ранения осколками стекла пассажиров. Триплекс состоит из пакета, образованного из двух или более листов обыкновенного стекла, между которыми проложена прозрачная пластичная пленка, прочно соединенная со стеклом склеивающим составом. Благодаря прочной склейке образующиеся при ударе осколки удерживаются на прокладке. Наиболее широко распространенным является трехслойный триплекс. В качестве органической прокладки в нем используют целлулоид. Его изготовление включает следующие операции стекла покрываются с одной стороны раствором желатина в воде и высушиваются, целлулоидная прокладка обрабатывается с двух сторон дигликолево-спиртовым составом, собранный пакет помещается в вакуум, а затем подогревается до 100 °С и прессуется в автоклаве при давлении около 15 атм. Заключительной операцией после обточки абразивными кругами является шпаклевка кромок триплекса смолистыми составами, предотвращающая действие воды на желатин и расслаивание изделия. [c.58]
Лабораторное стекло прежде всего должно быть устойчивым к воздействию химических агентов. Оно не должно в заметной степени выщелачиваться под действием воды, кислот или щелочей даже при повышенном давлении. Этим требованиям лучше всего отвечает стекло, в котором значительная часть щелочи, входящая в его состав, заменена на окислы металлов, менее растворимые в воде. [c.7]
Химическая стойкость стекла характеризуется его устойчивостью к действию воды, растворов солей, кислот и других агрессивных сред. [c.608]
В предыдущей статье мы рассказывали про виды обмазочной гидроизоляции. Сегодня мы обсудим несостоятельность гидроизоляции жидким стеклом, технологию нанесения и составы таких материалов, как жидкая резина, полимочевина, проникающая изоляция. Все они относятся к группе жидких гидроизоляционных материалов, при этом которые из них применяются не только в строительстве. Например, полимочевиной обрабатывают кузова автомобилей.
Жидкое стекло – это не гидроизоляция

Жидкое стекло растворяется в воде, о какой гидроизоляции может идти речь?
Одним из методов защиты бетона от влаги считается гидроизоляция жидким стеклом. Технология заключается в добавлении состава в раствор или обмазывании им рабочей поверхности. При этом внимания заслуживает только первый вариант. Все дело в свойствах жидкого стекла. Это силикат натрия либо калия, реже лития, а проще говоря, силикатный клей. Именно клей, а к гидроизоляции он имеет только косвенное отношение. Также читают: “Зачем и как правильно утеплить бетонный пол?“.
Применение жидкого стекла для гидроизоляции абсолютно не оправдано. Максимум что можно ожидать от этого материала – это увеличение прочности бетона и только при добавлении в раствор. После застывания силикат натрия по аналогу с обычным силикатным клеем образует некую пленку, которая действительно может задержать влагу. Но проблема заключается в том, что силикатный клей (жидкое стекло) растворяется в воде, поэтому со временем он вымывается из структуры бетона.
Гидроизоляция жидким стеклом своими руками методом нанесения на рабочую поверхность – занятие абсолютно бесполезное и вот почему:
- аккуратно нанести состав ровным слоем практически нереально;
- после застывания силикатный слой легко поцарапать.
- силикатная пленка смывается водой, причем достаточно быстро;
Получается, что намазывая жидкое стекло на пол или стены, вы не защищаете рабочую поверхность ни от воды, ни от механических повреждений. Максимум на что можно рассчитывать – это кратковременная, смываемая защита от каких-либо загрязнений. Порой даже этого достаточно. Например, если вы арендуете гараж под СТО, то жидкое стекло защитит пол от масла, которое можно будет смыть вместе с силикатной пленкой.
Часто задаваемый вопрос: “Для чего нужен байпас в системе отопления“? Если кратко, то для гарантирования циркуляции теплоносителя в контуре отопления.
О том, как сделать резервное питание для насоса отопления читайте здесь.
Жидкая резина

Распылитель с двумя соплами для жидкой резины.
Относительно новый, но уже нашумевший, метод защиты бетонных и металлических конструкций от влаги – это гидроизоляция жидкой резиной. Отзывы касательно этого материала неоднозначные. Одни делают ударение на преимуществах монтажа бесшовным методом (хотя есть аналоги и получше), а другие твердят о требовательности материала к подготовке рабочей поверхности и недолговечности. Действительно, этот состав нужно наносить на хорошо очищенную поверхность от пыли, чем часто пренебрегают монтажники. За всем нужно глаз да глаз. Из-за некачественной подготовки застывший состав быстро отслоится. Интересная статья: “Особенности утепления фундамента частного дома“.
Гидроизоляция жидкой резиной своими руками – задача невыполнимая, во всяком случае, если у вас нет специального оборудования. Жидкая резина – это битумно-полимерная эмульсия черного цвета, не содержащая растворителей. Мелкие частички битума (5 мкм) растворены в воде. Чтобы избежать слипания (коалесценции) частичек, в состав добавляется эмульгатор, который состоит из ионизированных молекул с одинаковым зарядом. Ионизированные молекулы обволакивают частички битума, в результате чего они будут отталкиваться и не слипнутся. В зависимости от заряда ионизированных молекул отличается и вид битумной эмульсии:
- положительный заряд – катионная эмульсия;
- отрицательный заряд – анионная эмульсия.
Эмульсия хранится в герметичных бочках годами и не застывает. Чтобы состав полимеризовался его нужно смешать с водным раствором хлористого калия.
Реакция проходит за несколько секунд, поэтому смешивать составы нужно перед самым нанесением. Для этого необходимо специальное оборудование для гидроизоляции жидкой резиной. Помимо компрессора, который создает давление, нужен двухфакельный распылитель. Это такой пистолет с двумя соплами. Из одного сопла подается битумная эмульсия, а из второго водный раствор хлористого калия. На пересечении факелов оба состава перемешиваются.
Полимочевина

Полимочевина бывает разных цветов.
Полимочевина (поликарбамид) по своей структуре похожа на полиуретан, при этом по некоторым показателям превосходит его. Например, время полимеризации полимочевины не более 30 секунд, в зависимости от вида. Этот жидкий гидроизоляционный материал может выпускаться в чистом виде или с добавками. Чистая полимочевина слишком дорогая, поэтому в гражданском строительстве более распространены ее гибридные составы, например, с добавлением полиуретана. Свойства поликарбамидов зависят от их состава, который может быть:
- с содержанием силикатов;
- эпоксиполимочевины;
- с примесями антипиренов;
- с добавлением гидрофобизаторов.
Поликарбамид выпускается как в виде жидкости (распыляемые), так и в виде жидкой мастики для гидроизоляции (полиаспартические).
От этого зависит и метод нанесения, который может быть ручным или с применением специального выдувного оборудования. После схватывания полимерного состава образуется эластичная плёнка с очень высокими эксплуатационными характеристиками. К примеру, прочность на разрыв застывшего поликарбамида составляет порядка 30 МПа.
Полимочевина бывает разных цветов. Чтобы краски не выцветали, в состав подавляют присадки, которые защищают от солнечных лучей. Так, есть алифатическая полимочевина, которая не боится солнца, и ароматическая полимочевина, которая со временем тускнеет. При этом характеристики обоих составов не отличаются:
- влаго и паронепроницаемость;
- короткое время схватывания;
- высокая адгезия к бетону, кирпичу, металлу, пластику прочее;
- неустойчивость к минеральным кислотам и растворителям.
По совокупности факторов полимочевину можно назвать самым лучшим жидким гидроизоляционным материалом.
Установленный стабилизатор для котла отопления нужен для выравнивания синусоиды электрического тока даже при скачках напряжения.
Что такое бак аккумулятор для ГВС и отопления и какие функции он выполняет читайте в этой статье.
Проникающая изоляция

Кристаллы Пенетрона не растворяются в воде.
Еще один вид жидкой гидроизоляции, который применяется изнутри – это Пенетрон (проникающий состав). Он используется только для монолитного бетона, штукатурки или стяжки. Не подходит для пеноблоков и кирпича, так как поры в их структуре слишком крупные. Пенетрон (проникающая гидроизоляция отечественно производства) фасуется в полиэтиленовые пакеты. Это сухой порошок по фактуре и цвету похожий на цемент.
Перед нанесением порошок растворяется в воде. Пропорции указаны на упаковке и важно чётко придерживаться инструкции. Разводить порошка в воде нужно ровно столько, сколько вы сможете выработать за 10 минут, так как по истечении этого времени состав кристаллизуется. Принцип работы заключается в том, что Пенетрон проникает глубоко в структуру бетона и закупоривает его поры кристаллами солей, которые в воде не растворяются. В результате этого бетон становится водонепроницаемым.
Расход Пенетрона на 1 м. кв составляет 0,4 кг/слой. Наносить состав нужно в два слоя кистью. Помните, что проникающая изоляция достаточно едкая, поэтому чтобы не получить химический ожог кожи нужно работать в перчатках и спецовке (штаны и китель с длинными рукавами). Перед нанесением нужно намочить рабочую поверхность, а после выполнения работ поддерживать защитный слой влажным в течение 3 дней. Это позволит составу набрать полную силу.
О едком и не очень / Хабр
– Эти идиоты поместили фарфоровый контейнер со «студнем» в специальную камеру, предельно изолированную… То есть это они думали, что камера предельно изолирована, но когда они открыли контейнер манипуляторами, «студень» пошел через металл и пластик, как вода через промокашку, вырвался наружу, и все, с чем он соприкасался, превращалось опять же в «студень». Погибло тридцать пять человек, больше ста изувечено, а все здание лаборатории приведено в полную негодность. Вы там бывали когда-нибудь? Великолепное сооружение! А теперь «студень» стек в подвалы и нижние этажи… Вот вам и прелюдия к контакту.
— А. Стругацкий, Б. Стругацкий «Пикник на обочине»
Привет, %username%!
В том, что я всё ещё что-то пишу — вините вот этого человека. Он навеял идею.
Просто, немного поразмыслив, я решил, что небольшой экскурс по едким веществам получится относительно быстро. Может кому-то будет и интересно. А кому-то — и полезно.
Поехали.
Сразу определимся с понятиями.
Едкий — 1. Разъедающий химически. 2. Резкий, вызывающий раздражение, боль. 3. Язвительный, колкий.
Ожегов С.И. Словарь русского языка. — М.: Рус.яз., 1990. — 921 с.
Итак, отбрасываем сразу два последних значения слова. Также отбрасываем «едкие» лакриматоры — которые не столько едкие, сколько вызывают слезотечение, и стерниты — которые вызывают кашель. Да, ниже будут вещества, которые обладают и этими свойствами, но они — что главное! — действительно разъедают материалы, а иногда и плоть.
Мы не будем рассматривать вещества, едкие только для человека и подобных — в виду специфического разрушения мембран клеток. А потому иприты останутся не у дел.
Мы будем рассматривать соединения, которые в комнатных условиях — жидкости. Поэтому жидкий кислород и азот, а также газы типа фтора рассматривать не будем, хотя их можно считать едкими, да.
Как обычно, взгляд будет исключительно субъективным, основанным на собственном опыте. И да — вполне возможно, что кого-то я и не упомню — пиши комментарии, %username%, в течение трёх суток с момента публикации я буду дополнять статью тем, что забылось с самого начала!
И да — у меня нет времени и сил строить «хит-парад», поэтому будет сборная солянка. И со всеми исключениями — она вышла довольно короткой.
Едкие щелочи
А конкретно — гидроксиды щелочных металлов: лития, натрия, калия, рубидия, цезия, франция, гидроксид таллия (I) и гидроксид бария. Но:
- Литий, цезий, рубидий и барий отбрасываем — дорого и редко встретишь
- Если ты, %username%, встретишь гидроксид франция, то едкость тебя будет волновать в последнюю очередь — он жутко радиоактивный
- То же и с таллием — он ядовит до жути.
А потому остались натрий и калий. Но будем откровенны — свойства у всех едких щелочей очень схожие.
Гидроксид натрия известен всем как «каустическая сода» (не путать с пищевой, кальцинированной и другими содами, а также поташем). Гидроксид калия как пищевая добавка Е525 — тоже. По свойствам оба похожи: сильно гигроскопичны, то бишь тянут воду, на воздухе «расплываются». Хорошо растворяются в воде, при этом выделяется большое количество теплоты.
«Расплывание» на воздухе — по сути образование очень концентрированных растворов щелочей. А потому, если положить кусочек едкой щёлочи на бумагу, кожу, некоторые металлы (тот же алюминий) — то по прошествии времени обнаружится, что материал хорошо подъело! То, что показывали в «Бойцовском клубе» — очень похоже на правду: действительно, потные руки — да в щёлочь — будет больно! Лично мне показалось больнее, чем от соляной кислоты (о ней ниже).
Впрочем, если руки очень сухие — скорее всего в именно сухой щёлочи ничего и не почувствуешь.
Едкие щёлочи отлично разваливают жиры на глицерин и соли жирных кислот — так и варят мыло (привет, «Бойцовский клуб!») Чуть дольше, но так же действенно расщепляются белки — то есть в принципе щёлочи плоть растворяют, особенно крепкие растворы — да при нагревании. Недостатком в сравнении с той же хлорной кислотой (о ней тоже ниже) является то, что все щёлочи тянут углекислый газ из атмосферы, а потому сила будет постепенно снижаться. Кроме того, щёлочи реагируют и с компонентами стекла — стекло мутнеет, хотя, чтобы его растворить целиком — тут, конечно, надо постараться.
К едким щелочам иногда относят и тетраалкиламмоний гидроксиды, например
Гидроксид тетраметиламмонияНа самом деле в этих веществах объединились свойства катионных поверхностно-активных веществ (ну это как обычное мыло — только катионное: тут активная дифильная частица — с зарядом «+», а в мыле — с зарядом «-«) и относительно высокая основность. Если попадёт на руки — можно намылить в воде и помыть, как мылом, если в водном растворе погреть волосы, кожу или ногти — растворятся. «Едкость» на фоне гидроксидов натрия и калия — так себе.
Серная кислота
H2SO4
Самая популярная, наверное, во всех историях. Не самая едкая, но достаточно неприятная: концентрированная серная кислота (которая 98%) — маслянистая жидкость, которая очень любит воду, а потому у всех её отнимает. Отнимая воду у целлюлозы и сахара, обугливает их. Точно так же она радостно отнимет воду и у тебя, %username%, особенно если налить её на нежную кожу лица или в глаза (ну в глаза на самом деле всё будет попадать с приключениями). Особо добрые люди мешают серную кислоту с маслом, чтобы труднее смывалась и лучше впитывалась в кожу.
Кстати, забирая воду, серная кислота здорово разогревается, что делает картину ещё больше сочной. А потому смывать её водой — очень плохая идея. Лучше — маслом (смывать, а не втирать — а потом уже смыть водой). Ну или большим потоком воды, чтобы сразу и охлаждать.
«Сначала вода, а потом кислота — иначе случится большая беда!» — это именно про серную кислоту, хотя почему-то все считают, что про любую кислоту.
Будучи окислителем, серная кислота окисляет поверхность металлов до оксидов. А поскольку взаимодействие оксидов с кислотами проходит при участии воды как катализатора — а воду серная кислота не отдаёт — то происходит эффект, называемый пассивацией: плотная, нерастворимая и непроницаемая плёнка оксида металла защищает его от дальнейшего растворения.
По этому механизму концентрированную серную кислоту посылают в далёкие дали железо, алюминий. Примечательно, что если кислоту разбавить — появляется вода, и посылать не получается — металлы растворяются.
Кстати, оксид серы SO3 растворяется в серной кислоте и получается олеум — который иногда ошибочно пишут как H2S2O7, но это не совсем верно. У олеума тяга к воде ещё больше.
Собственные ощущения от попадания серной кислоты на руку: немного тепло, потом чуток печёт — смыл под краном, ничего страшного. Фильмам не верьте, но на лицо капать не советую.
Органики часто пользуются хромпиком или «хромовой смесью» — это бихромат калия, растворённый в серной кислоте. По сути это — раствор хромовой кислоты, он хорош для мытья посуды от остатков органики. При попадании на руку тоже жжётся, но по сути — серная кислота плюс токсичный шестивалентный хром. Дырок в руке не дождёшься, разве что на одежде.
Автор этих строк знаком с идиотом, который вместо бихромата калия использовал перманганат калия. При контакте с органикой немножко жахнуло. Присутствующие обделались отделались лёгким испугом.
Кстати, раз уж вспомнили хромпик — немного отвлечёмся от темы кислот и
Хлористый хромил
CrO2Cl2
По сути своей — лютое соединение шестивалентного хрома и соляной кислоты. Тёмно-красная жидкость, которая тянет воду, гидролизуется — и в итоге дымит этой самой соляной кислотой. Едкость — итог этого братского единения: хром — окисляет, соляная кислота — растворяет: воспламеняет некоторые органические растворители (спирт, скипидар), однако в некоторых растворяется (четыреххлористый углерод, дихлорметан, сероуглегод). Подъедает металлы, но не настолько хорошо, как кислоты — опять дело в пассивации. например, сталь при воздействии приобретает красивую тёмно-синию поверхность.
Кожу — понятно — изъязвляет, при чём в этом сильнее хромпика, поскольку лучше проникает в кожу как в неполярную органическую ткань. Но дело даже не в этом, а в шестивалентном хроме, который вообще-то канцероген, а потому глубже проникнет — больше проблем. Ну и конечно надышаться куда опаснее.
Соляная кислота
HCl
Выше 38% в воде не бывает. Одна из самых популярных кислот для растворения — в этом она покруче остальных, потому что технологически может быть очень чистой, а кроме действия, как кислота, ещё и образует комплексные хлориды, которые повышают растворимость. Кстати, именно по этой причине нерастворимый хлорид серебра очень даже растворим в концентрированной соляной кислоте.
Эта при попадании на кожу жжётся чуток сильнее, субъективно — ещё и зудит, к тому же воняет: если в лаборатории с плохой вытяжкой работать много с концентрированной соляной кислотой — твой стоматолог скажет тебе «спасибо»: ты его озолотишь на пломбах. Кстати, помогает жвачка. Но не сильно. Лучше — вытяжка.
Поскольку не маслянистая и с водой сильно не разогревается, то едкость — только к металлам, и то не ко всем. Кстати, сталь в концентрированной соляной кислоте пассивируется и говорит ей «не-а!». Чем и пользуются при транспортировке.
Азотная кислота
HNO3
Тоже очень популярная, её тоже почему-то боятся — а зря. Концентрированная — это которая до 70% — она самая популярная, выше — это «дымящая», чаще всего никому не нужная. Есть ещё безводная — так та ещё и взрывается.
Будучи окислителем, пассивирует многие металлы, которые покрываются нерастворимой плёнкой и говорят: «до свидания» — это хром, железо, алюминий, кобальт, никель и другие.
С кожей моментально реагирует по принципу ксантопротеиновой реакции — будет жёлтое пятно, что означает, что ты, %username%, всё-таки состоишь из белка! Через какое-то время жёлтая кожа слезет, как при ожоге. При этом щиплет меньше соляной, хотя воняет не хуже — и на этот раз токсичнее: летящие окислы азота не очень хороши для организма.
В химии используют так называемую «нитрующую смесь» — самая популярная состоит из серной и азотной кислот. Используется в синтезах, в частности в получении весёлого вещества — пироксилина. По едкости — тот же хромпик плюс красивая жёлтая кожа.
Так же есть «царская водка» — это часть азотной кислоты на три части соляной. Используется для растворения некоторых металлов, в основном — драгоценных. На разном соотношении и добавлении воды основан капельный метод проверки пробы золотых изделий — кстати, специалистов по этому методу очень сложно надурить с подделкой. По едкости для кожи — та же «нитрующая смесь» плюс воняет отменно, запах не спутаешь ни с чем, он тоже довольно токсичный.
Есть ещё «обратная царская водка» — когда соотношение наоборот, но это редкая специфика.
Кстати, о той самой «дымящей», которая красная, злая и окислитель — цитирую рассказ хорошего друга, который мне вот прямо сейчас прислал.
Гнал я эту самую 98% азотку. То ли просто перегонял для очистки, то ли из меланжа, уже не помню. Нагнал литра два, снимаю приемник. Прошу лаборантку дать чистую колбу на 2 литра — перелить. Она мне и дала сухую, чистую, но из под спирта — и с закрытой пробкой. То есть пары были и накопились. Я туда воронку и переливаю. Я ее туда — а она обратно. Хорошо брызнула на руки, на рожу и ниже шеи. Ощущение — как орел в морду вцепился. Плюс руки, шея, под носом ну и т.д. по мелочи. В руках, напоминаю, два литра того же добра. Глаза закрыты, естественно. Понимаю, что бросить колбу нельзя, будет сразу сильно хуже. Аккуратно ставлю колбу на резиновую подставку, перемещаюсь к мойке, разворачиваю гусак себе в морду и включаю полный напор. Секунд за пять управился. До подкожной клетчатки не добралась. А то все было бы намного хуже. Видел у другого мужика, что бывает через 10-15 сек. Труднозаживающие багровые рубцы на половину руки. Потом понял, почему она такая злая. Мало того, что довольно сильная кислота и окислитель, она еще и чудесный растворитель. Неограниченно смешивается с водой, но неограниченно смешивается и с, например, дихлорэтаном. Такая себе бифильная дрянь.
Фосфорная кислота
H3PO4
На самом деле я привёл формулу ортофосфорной кислоты — самой распространённой. А есть ещё метафосфорная, полифосфорные, ультрафосфорные — короче, хватает, но неважно.
Концентрированная ортофосфорная кислота (85%) — это такой сиропчик. Кислота она сама по себе средняя, её часто используют в пищевой промышленности, кстати — когда тебе ставят пломбы, то поверхность зуба предварительно протравливают фосфорной кислотой.
Коррозионность у неё так себе, но есть неприятный нюанс: этот сиропчик хорошо впитывается. Поэтому если капнет на вещи — впитается, а потом будет потихоньку разъедать. И если от азотной и соляной кислоты будет пятно или дырка — то от фосфорной вещь будет разлазиться, особенно это красочно на обуви, когда дырка как бы крошится, пока не получится насквозь.
Ну а вообще едкой её назвать сложно.
Плавиковая кислота
HF
Концентрированная плавиковая кислота — это примерно 38%, хотя и бывают странные исключения.
Слабенькая кислота, которая берёт яростной любовью фторид-ионов образовывать стойкие комплексы со всем, с кем можно. Поэтому на удивление растворяет то, что другие, более сильные подруги — не могут, а потому очень часто используется в разных смесях для растворения. При попадании на руку ощущения будут больше от других компонентов таких смесей, но есть нюанс.
Плавиковая кислота растворяет SiO2. То есть песок. То есть стекло. То есть кварц. Ну и так далее. Нет, если ты плеснёшь на окно этой кислотой — оно не растворится, но мутное пятно останется. Чтобы растворить — нужно долго держать, а ещё лучше — нагреть. При растворении выделяется SiF4, который так полезен для здоровья, что лучше это делать под вытяжкой.
Маленький, но приятный нюанс: кремний содержится у тебя, %username%, в ногтях. Так вот, если плавиковая кислота попадёт под ногти — ты ничего не заметишь. Но ночью спать не сможешь — болеть будет ТАК, что иногда возникает желание оторвать палец. Поверь, друг — я знаю.
И вообще плавиковая кислота токсична, канцерогенна, впитывается через кожу и масса всего — но мы-то сегодня про едкость, правда?
Помнишь, мы договаривались в самом начале, что фтора не будет? Его и не будет. Но будут…
Фториды инертных газов
На самом деле фтор — суровый парень, с ним особо не повыпендриваешься, а потому некоторые инертные газы образуют с ним фториды. Известны такие стабильные фториды: KrF2, XeF2, XeF4, XeF6. Всё это — кристаллы, которые на воздухе с разной скоростью и охотой разлагаются влагой до плавиковой кислоты. Едкость — соответствующая.
Иодоводородная кислота
HI
Самая сильная (по степени диссоциации в воде) бинарная кислота. Сильный восстановитель, чем пользуются химики-органики. На воздухе окисляется и становится бурой, чем и пачкает при контакте. Ощущения при контакте — как от соляной. Всё.
Хлорная кислота
HClO4
Одна из самых сильных (по степени диссоциации в воде) кислот вообще (с ней конкурируют суперкислоты — о них ниже) — функция кислотности Гаммета (численное выражение способности среды быть донором протонов по отношению к произвольному основанию, чем меньше — тем сильнее кислота) составляет -13. Безводная — сильный окислитель, любит взрываться, да и вообще неустойчива. Концентрированная (70%-72%) — окислитель не хуже, часто используют в разложении биологических объектов. Разложение интересно и захватывающе тем, что может взрываться в процессе: нужно следить, чтобы не было частиц угля, чтобы не кипело слишком бурно и т.д. Хлорная кислота к тому же довольно грязная — её невозможно очистить субперегонкой, взрывается зараза! Поэтому используют её нечасто.
При попадании на кожу жжётся, ощущения как от соляной. Воняет. Когда видите в фильмах, что кто-то кинул труп в ёмкость с хлорной кислотой — и он растворился, то да, такое возможно — но долго или греть. Если греть — может рвануть (см. выше). Так что будьте критичны к кинематографу (я, кажется, видел это в «Кловерфилд, 10»).
Кстати, едкость оксида хлора (VII) Cl2O7 и оксида хлора (VI) Cl2O6 — это итог того, что с водой эти оксиды образуют хлорную кислоту.
А теперь представим, что мы решили в одном соединении объединить сильную кислотность — и едкость фтора: возьмём молекулу хлорной или серной кислоты — и заменим на ней все гидроксильные группы на фтор! Дрянь получится редкостная: она будет взаимодействовать с водой и подобными соединениями — и будет в месте реакции сразу получаться сильная кислота и плавиковая кислота. А?
Фториды серы, брома и иода
Помните, мы договорились рассматривать только жидкости? По этой причине в нашу статью не попал трифторид хлора ClF3, который кипит при +12 °C, хотя все страшилки о том, что он жутко токсичен, воспламеняет стекло, противогаз и при разливании 900 килограммов — проедает 30 см бетона и метр гравия — всё это правда. Но мы же договорились — жидкости.
Однако есть жёлтая жидкость — пентафторид иода IF5, бесцветная жидкость — трифторид брома BrF3, светло-жёлтая — пентафторид брома BrF5, которые не хуже. BrF5, к примеру, тоже растворяет стекло, металлы и бетон.
Аналогично — среди всех фторидов серы жидким является только декафторид дисеры (иногда её называют ещё пятифтористой серой) — бесцветная жидкость с формулой S2F10. Но это соединение при обычных температурах достаточно стабильно, не разлагается водой — а потому не особо и едко. Правда, в 4 раза токсичнее фосгена с аналогичным механизмом действия.
Кстати, говорят, что пентафторид иода был «специальным газом» для заполнения атмосферы в спасательном шаттле в последних кадрах фильма «Чужой» 1979 года. Ну не помню, честно. Напомнился! Блин, там настолько круто, что я не удержался — и посвятил этому отдельную статью.
Суперкислоты
Термин «суперкислота» введён Джеймсом Конантом в 1927 году для классификации более сильных кислот, чем обычные минеральные кислоты. В некоторых источниках хлорную кислоту относят к суперкислоте, хотя это не так — она обычная минеральная.
Ряд суперкислот — это минеральные, к которым подцепили галоген: галоген тянет на себя электроны, все атомы очень сильно гневаются, а достаётся всё как обычно водороду: тот отваливается в виде Н+ — бабах: вот и кислота стала сильнее.
Примеры — фторсерная и хлорсерная кислотыУ фторсерной кислоты функция Гаммета -15,1, кстати, благодаря фтору, эта кислота постепенно растворяет пробирку, в которой хранится.
Потом кто-то из умных подумал: а давайте возьмём кислоту Льюиса (вещество, способное принять пару электронов другого вещества) и смешаем с кислотой Бренстеда (веществом, которое способно отдавать протон)! Смешали пентафторид сурьмы с плавиковой кислотой — получили гексафторсурьмяную кислоту HSbF6. В этой системе плавиковая кислота выделяет протон (H+), а сопряжённое основание (F−) изолируется координационной связью с пентафторидом сурьмы. Так образуется большой октаэдрический анион (SbF6−), являющийся очень слабым нуклеофилом и очень слабым основанием. Став «свободным», протон обусловливает сверхкислотность системы — функция Гаммета -28!
А потом пришли другие и сказали, а чего это кислоту Бернстеда взяли слабую — и придумали вот что.
Трифторметансульфоновая кислота— сама по себе уже суперкислота (функция Гаммета -14,1). Так вот, к ней добавили опять пентафторид сурьмы — получили снижение до -16,8! Такой же фокус с фторсерной кислотой дал снижение до -23.
А потом группа ученых с химической кафедры американского университета Калифорнии под управлением профессора Кристофера Рида затусила с коллегами из Института катализа СО РАН (Новосибирск) и придумали карборановую кислоту H(CHB11Cl11). Ну «карборановой» её назвали для обычных людей, а если хочешь почувствовать себя учёным — произнеси «2,3,4,5,6,7,8,9,10,11,12-ундекахлор-1-карба-клозо-додекаборан(12)» три раза и быстро.
Так выглядит эта красоткаЭто — сухой порошочек, который растворим в воде. Это и есть Самая Сильная Кислота на текущий момент. Карборановая кислота приблизительно в миллион раз сильнее концентрированной серной кислоты. В обычных шкалах измерить силу кислоты не удается, так как кислота протонирует все известные слабые основания и все растворители, в которых она растворяется, включая воду, бензол, фуллерен-60, диоксид серы.
Впоследствии Кристофер Рид в интервью службе новостей Nature сказал: «Идея синтеза карборановой кислоты родилась из фантазий «о молекулах, никогда прежде не создаваемых». Вместе с коллегами он хочет использовать карборановую кислоту для окисления атомов инертного газа ксенона — просто потому, что никто прежде этого не делал. Оригинально, что сказать.
Ну поскольку суперкислоты — это обычные кислоты, то и действуют они обычно, только немного сильнее. Ясно, что кожу будут жечь, но это не значит — что растворять. Фторсульфоновая — отдельный случай, но там всё благодаря фтору, как и в плавиковой.
Тригалогенуксусные кислоты
А конкретно — трифторуксусная и трихлоруксусная кислота
Милы и приятны сочетанием свойств органического полярного растворителя и достаточно сильной кислоты. Воняют — похоже на уксус.
Самая няшка — трифторуксусная кислота: 20%-ный раствор разрушает металлы, пробку, резину, бакелит, полиэтилен. На коже жжётся и образует сухие язвы, доходящие до мышечного слоя.
Трихлоруксусная в этом плане — младший брат, но тоже ничего. Кстати, аплодисменты слабому полу: в погоне за красотой, некоторые идут на так называемую процедуру ТСА-пилинга (ТСА — это TetraChloroAcetate) — когда этой самой трихлоруксусной кислотой растворяют верхний огрубевший слой кожи.
Уксусная кислота
СН3СООН
Скорее всего, у тебя на кухне есть эта кислота — и да, она используется как пищевая добавка Е260. Но также она бывает и покрепче — 70-80%-й водный раствор уксусной кислоты называют уксусной эссенцией, а если концентрация близка к 100% — ледяной уксусной кислотой (потому что она может замерзать и образовывать нечто похожее на лёд.
Уксусная кислота не так едка по отношению к металлам, как минеральные кислоты, но поскольку и не так полярна, а в какой-то степени даже дифильна (сочетание гидрофобной и гидрофильной части в одной молекуле — как в поверхностно-активных веществах) — то она здорово всасывается кожей. Опасными считаются растворы с концентрацией уксусной кислоты больше 30%. Особенность ожогов в том, что также инициируется развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины — если не смыть, то будут долго заживающие язвы и рубцы.
Ну и воняет она, конечно, знатно.
Муравьиная кислота
НСООН
Мы уже обсуждали, что муравьиная кислота, образующаяся в организме после принятия метанола, — одна из основных причин его токсичности. Так вот, муравьиная кислота извне вовсе не так опасна, поскольку быстро метаболизируется и выводится организмом. Токсичность довольно низка — для крыс LD50 порядка 1,8 г/кг, а потому муравьиную кислоту тоже часто используют, в том числе и как пищевую добавку — и этого бояться не стоит.
»Едкость» муравьиной кислоты зависит от концентрации. Согласно классификации Европейского союза, концентрация до 10% обладает раздражающим эффектом, больше 10% — разъедающим. И речь опять не о металлах и стекле — а об организме. При контакте с кожей 100%-я жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Кислота легко проникает через жировой слой кожи, поэтому промывание поражённого участка раствором соды необходимо произвести немедленно. Так что муравьи действительно что-то знают.
Бром
Br2
Тяжёлая едкая жидкость красно-бурого цвета с сильным неприятным запахом, отдалённо напоминающим запах одновременно иода и хлора. Кстати, название «бром» от греческого βρῶμος — «вонючка», «вонючий».
Бром — типичный галоген, по химической активности бром занимает промежуточное положение между хлором и иодом. То есть не такой прыткий, как фтор — но поживее скучного иода. И да, до хлора тоже не дотягивает.
Немного растворим в воде, хорошо — в некоторых органических растворителях. Бромная вода — реактив на непредельные углеводороды — воняет, но вполне себе мирная и ничего сильно не растворяет.
Чистый бром могуч, вонюч и волосат, а также токсичен. При попадании на кожу вызывает ожоги: неприятность в том, что молекулы брома неполярны, а потому хорошо проникают в гидрофобную человеческую кожу и плоть — а потому ожоги действительно болезненны, долго заживают, почти всегда оставляют на память шрам. Алюминий вспыхивает при контакте с бромом, остальные металлы более воздержаны, но в виде порошка — некоторые реагируют, например, железо.
Бетон и стекло к брому достаточно устойчивы. Органические соединения бромом — что? — правильно! — бромируются при наличии ненасыщенной связи. По этой причине устойчивость полимеров зависит от их типа, к примеру полиэтилен и полипропилен — плевать хотели на бром при комнатных условиях.
Пероксид водорода
H2O2
Нестабильное соединение, которое постоянно постепенно разваливается на кислород и воду. Чем выше концентрация — тем нестабильнее, что постепенно превращается во взрывоопасность. Для стабилизации технического пероксида водорода в него добавляют пирофосфат или станнат натрия; при хранении в алюминиевых емкостях используют ингибитор коррозии — нитрат аммония.
Пероксид водорода в лаборатории обычно представляет собой раствор 38%. При попадании на кожу оказывает химический ожог с характерным белым окрашиванием. Ожог болезненный, особенно на тонкой коже, побелевшая ороговевшая кожа потом часто трескается и зудит.
В медицине используют 3% пероксид водорода для очистки глубоких ран сложного профиля, гнойных затёков, флегмон и других гнойных ран, санация которых затруднена — так вещество обладает не только антисептическим эффектом, но и создаёт большое количество пены при взаимодействии с ферментом каталазой. Это в свою очередь позволяет размягчить и отделить от тканей некротизированные участки, сгустки крови, гноя, которые будут легко смыты последующим введением в полость раны антисептического раствора. Кстати, перекись водорода нежелательна в других случаях ран: обладая хорошими очищающими свойствами, это вещество на самом деле не ускоряет процесс заживления, поскольку повреждает прилегающие к ране клетки, равно как и молодые, новообразующиеся ткани — а это ещё и чревато образованием рубцов.
Кроме как ожогов на коже — ничего не разъедает и не растворяет. Металлы, стекло и пластики устойчивы к пероксиду водорода.
А ещё пероксид водорода подарил миру много уникальных натуральных блондинок с чёрными корнями волос!
Близки к пероксиду водорода так называемые надкислоты — кислоты, в которых присутствуют пероксидные группы. Пример: надуксусная кислота СН3СОООН — вещество, напоминающее по свойствам пероксид водорода, а потому и использующееся точно в таких же сферах. Есть «первомур» или «С-4» (нет, это не тот С-4, о котором ты подумал) — это пермуравьиная кислота HCOOOН, которая ещё слабее надуксусной, а потому хирируги моют ей руки перед операцией. И наконец — трифторперуксусная кислота СF3СОООН — лютый, бешеный окислитель, на который с восхищением смотрят химики-органики за возможность окисления анилина до нитробензола, получения гипервалентного иода в органических соединениях, реакцию Байера-Виллигера и другие малопонятные нормальным людям вещи. По едкости — трифторуксусная кислота, смешанная с перекисью водорода, чем, собственно, и является, а потому для рук представляет особую опасность, да. В виду своей высокой окислительной способности, трифторперуксусная кислота не продаётся, а обычно получается восхищающимися химиками-органиками прямо там, где необходимо, взаимодействием трифторуксусного ангидрида с пероксидом водорода.
Ну вот примерно так, если говорить про жидкость и про едкость. Будут ещё дополнения?
растворенных газов в очищенной воде
Перейти к основному содержанию- Об ELGA
- Об ELGA
- Сверхчистая вода
- Технологии очистки
- Примеси в воде
- Руководства и официальные документы
- Утвержденные партнеры SustainSizeStainSide RiseSide
- Sustainis
- Карьера
- События
- ВЭЖХ в фармацевтике
- ВЭЖХ Чистота воды
- Блог
- Аналитическая химия
- Клиническая и фармацевтическая продукция
- Cool Science
- Экологическая и экологическая устойчивость
- Life Design в
- Life Design of
- Life Design in
- Life
- Наука будущего
- Чистота воды
- Вода в лаборатории
Поиск
Английский- Deutsch
- Español
- Français
- Italiano
- Portugu Ues
- 日本語 中文
Переключение навигации
- Продукты Применения
- Кейсы
- Продукты PURELAB
- CENTRA MEDICA
- BioPure ELGA Полный Ассортимент продукции
- Области применения
- Тематические исследования
- Раскрытие секретов Антарктики с помощью сверхчистой воды
- Диагностика Abbott выбирает системы ELGA MEDICA в Южной Азии
- Университет Ка’Фоскари — новый метод исследования окружающей среды на льду
- Университет Ка’Фоскари — исследование загрязняющих веществ в антарктическом льду
- DASA: крупнейшая компания по медицинской диагностике в Бразилии
- ELGA помогает иммуносерологическим лабораториям максимально увеличить время безотказной работы
- Важность сверхчистой воды типа 1+ для разработка непатентованных лекарств
- MEDICA® Pro выбран для анализаторов Siemens ADVIA® в Городской больнице общего профиля
- Optimale Wasserqualität für mikrobiologische Forschung und Lehre
- PURELAB® flex: идеальная система обучения для современного исследовательского метода
- sservers Reiser
- Поддержка и услуги
- Планирование лаборатории
- Регистрация продукта
- Регистрация вашего продукта (только для США и Канады)
- на открытую кнопку
- В этой функции PURELAB
- PURELAB Chorus 1 Complete
- PURELAB® Chorus 1
- PURELAB Chorus 2+
Почему важен растворенный в воде кислород
Растворенный кислород (DO) — это растворенный в воде кислород. Кислород растворяется путем диффузии из окружающего воздуха; аэрация воды, которая упала на водопады и пороги; и как ненужный продукт фотосинтеза. Ниже приведена упрощенная формула:
Фотосинтез (в присутствии света и хлорофилла):
Углекислый газ | + | Вода | — Вода ————> | Кислород | + | Продукты, богатые углеродом |
CO 2 | H 2 O | O 2 | C 6 H 12 O 6 |
Температурный эффект
Если вода слишком теплая, в ней может быть недостаточно кислорода. Когда в этом районе слишком много бактерий или водных животных, они могут перенаселиться, используя DO в больших количествах.
Уровни кислорода также могут быть снижены путем чрезмерного оплодотворения водных растений из-за стока с сельскохозяйственных полей, содержащих фосфаты и нитраты (ингредиенты в удобрениях). В этих условиях количество и размеры водных растений увеличиваются. Затем, если погода станет облачной в течение нескольких дней, респираторные заводы будут использовать большую часть доступного DO. Когда эти растения умирают, они становятся пищей для бактерий, которые, в свою очередь, размножаются и используют большое количество кислорода. И это истощает весь кислород.
Сколько нужно водному организму, зависит от его вида, его физического состояния, температуры воды, присутствующих загрязнителей и многого другого. Следовательно, невозможно точно предсказать минимальные уровни DO для конкретных рыб и водных животных. Например, при 5 o C (41 o F) форель использует около 50-60 миллиграммов (мг) кислорода в час; при 25 o C (77 o F) им может понадобиться в пять или шесть раз больше этой суммы. Рыбы — хладнокровные животные. Они используют больше кислорода при более высоких температурах, потому что их скорость метаболизма увеличивается.
Многочисленные научные исследования показывают, что 4-5 частей на миллион (ppm) DO — это минимальное количество, которое будет поддерживать большую, разнообразную популяцию рыб. Уровень DO в хороших рыболовных водах обычно составляет в среднем около 9,0 частей на миллион (промилле).
На графике ниже вы можете увидеть влияние температуры в DO
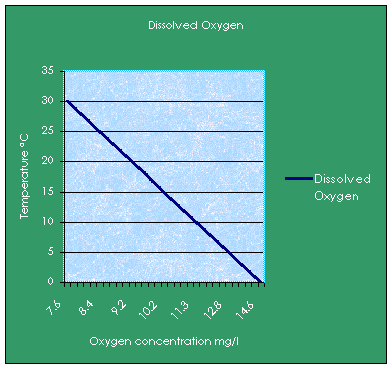
Воздействие на окружающую среду
Общая концентрация растворенного газа в воде не должна превышать 110 процентов.Концентрации выше этого уровня могут быть вредными для водной жизни. Рыба в водах, содержащих чрезмерно растворенные газы, может страдать от «газового пузыря»; однако это очень редкое явление. Пузырьки или эмболы блокируют кровоток через кровеносные сосуды, вызывая смерть. Внешние пузыри (эмфизема) также могут возникать и могут быть видны на плавниках, на коже и на других тканях. Водные беспозвоночные также страдают от газовых пузырьков, но на уровнях выше, чем смертельные для рыб.
Достаточное количество растворенного кислорода необходимо для хорошего качества воды.Кислород является необходимым элементом для всех форм жизни. Процессы очистки естественного потока требуют адекватного уровня кислорода для обеспечения аэробных форм жизни. Поскольку уровень растворенного кислорода в воде падает ниже 5,0 мг / л, водная жизнь подвергается стрессу. Чем ниже концентрация, тем больше стресс. Уровень кислорода, который остается ниже 1-2 мг / л в течение нескольких часов, может привести к гибели крупных рыб.
С биологической точки зрения уровень кислорода является гораздо более важной мерой качества воды, чем фекальная кишечная палочка.Растворенный кислород абсолютно необходим для выживания всех водных организмов (не только рыб, но и беспозвоночных, таких как крабы, моллюски, зоопланктон и т. Д.). Кроме того, кислород влияет на огромное количество других водных показателей, не только биохимических, но и эстетических, таких как запах, чистота и вкус. Следовательно, кислород является, пожалуй, наиболее известным показателем качества воды.
Загрязнение реки
На графике ниже вы можете увидеть процентное содержание кислорода, растворенного в реке «Темза» в период (1890-1974), в гавани Нью-Йорка в период (1910-1997) ) и река «Рейн» в период (1945-1997).Здесь мы можем видеть, как уровни кислорода для некоторых крупных рек вернулись к предыдущим высоким уровням после десятилетий низких уровней. Это имеет последствия как для морских организмов, так и для людей. Повышенные уровни процентного содержания растворенного кислорода улучшили возможности водной жизни.
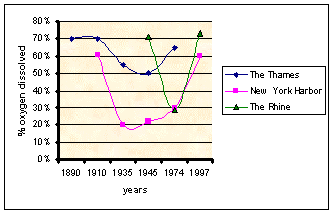
Источник: Скептик-эколог; измерение реального состояния мира . Автор: Bjorn Lomborg
Как растворенный кислород влияет на водоснабжение
Высокий уровень DO в коммунальном водоснабжении хорош, потому что он улучшает вкус питьевой воды.Однако высокий уровень DO ускоряет коррозию в водопроводных трубах. По этой причине в промышленности используется вода с наименьшим количеством растворенного кислорода. Вода, используемая в котлах с очень низким давлением, имеет не более 2,0 частей на миллион DO, но большинство операторов котельных стараются поддерживать уровень кислорода до 0,007 частей на миллион или ниже.

 Часто задаваемый вопрос: “Для чего нужен байпас в системе отопления“? Если кратко, то для гарантирования циркуляции теплоносителя в контуре отопления.
Часто задаваемый вопрос: “Для чего нужен байпас в системе отопления“? Если кратко, то для гарантирования циркуляции теплоносителя в контуре отопления. Установленный стабилизатор для котла отопления нужен для выравнивания синусоиды электрического тока даже при скачках напряжения.
Установленный стабилизатор для котла отопления нужен для выравнивания синусоиды электрического тока даже при скачках напряжения.